摘要
皮肤色素沉着确保了有效的光保护,并依赖于黑色素,黑色素由表皮黑色素细胞产生并转移到周围的角质形成细胞。虽然黑色素细胞中黑色素合成和转运的分子机制现在已经很好地表征,但关于黑色素在角质形成细胞中的转移和加工却知之甚少。在过去的几十年中,已经提出了不同的模型来解释黑色素如何在细胞和分子水平上转移。然而,这仍然是一个有争议的话题,因为已经提出了四种不同的模型,每个模型都有支持的证据。在这里,本文回顾了目前关于黑色素胞吐,内化,加工和极化的调节的知识。关于不同的转移模型,本文讨论了这些模型如何在不同条件下共存以调节皮肤色素沉着,即构成性和诱导性皮肤色素沉着或生理和病理条件。此外,本文讨论了最近的证据,这些证据揭示了黑色素细胞分泌黑色素和角质形成细胞内化的调控,以及黑色素是如何储存在命名为“黑素角质体(melanokerasome)”的区室中。最后,本文回顾了关于导致黑素角质体定位在角质形成细胞核上方,形成保护核DNA免受紫外线辐射的核上帽的分子机制的最新进展。因此,本文提供了一个关于调节皮肤色素沉着的分子机制的当前知识的全面概述,从黑色素细胞的黑色素分泌和角质形成细胞的内化到角质形成细胞的加工和极化。对这些分子机制有更深入的了解将有助于阐明该领域长期存在的关键问题,这对理解皮肤色素沉着至关重要,并能为揭示细胞器生物学的基本方面提供新的见解。最终,这些知识有助于开发新的治疗方法来治疗色素沉着过度或不足的疾病,这些疾病给患者和全球医疗系统带来了沉重的社会经济负担,同时也可用于化妆品应用。
01 引言
皮肤是人体最大的器官,在水分平衡、 调节体温、抵御外来物质和紫外线辐射 (UVr)等方面发挥着重要作用。皮肤的上层——表皮——主要由角质细胞组成,占该层细胞的 80%以上。角质形成细胞根据其分化状态分为五个不同的层:基底层、棘层、颗粒层,透明层(仅在厚皮中可见)和角质层。表皮中还含有黑色素细胞,黑色素细胞是胚胎发育期间源自神经嵴的特化细胞。黑色素细胞分散在整个基底层,并可延伸至接触多达40 个角质形成细胞,形成“表皮黑色素单位”(图 1A)。黑素细胞的功能是合成色素黑色素,随后将其转移到角质形成细胞。黑色素有两种类型:黑色/棕色真黑色素(eumelanin)和黄色/红色类黑色素(pheomelanin)。这些是在黑素体内的黑素细胞中合成的,黑素体是溶酶体相关细胞器(LROs),因为它们是内体细胞衍生的,含有溶酶体标记物,并且在其生物发生的早期阶段是酸性的。黑素体表现出四个不同的成熟阶段:在阶段I和II,它们是非色素沉着的,最初类似于多囊泡外泌体。类黑色素体(pheomelanosomes)保持球形,而真黑素体由于前黑素体蛋白(PMEL)的内部纤维核化而呈椭圆形。在阶段III,真黑素合成所需的黑色素生成酶,包括酪氨酸酶和酪氨酸酶相关蛋白(TYRP1/2),被募集到III期黑色素小体,黑色素开始逐渐沉积到PMEL原纤维上,直到黑色素小体完全实现色素沉着(阶段IV)。成熟的黑色素体在黑色素细胞的树突中积累,然后被转移到角质形成细胞。在被表皮细胞吸收后,黑色素会被加工(即被转运),然后在核上区域积累,在那里发挥保护这些细胞的DNA免受UVr损伤的功能。因此,皮肤色素沉着是几个过程的结果,包括黑色素在黑色素细胞中合成,从黑色素细胞转移到角质形成细胞,以及在角质形成细胞内加工。参与黑色素合成和在黑色素细胞内转运的分子机制现在已经被很好地表征了,但是黑色素转移的机制仍然存在争议并且缺乏表征。此外,只有少数研究解决了黑色素如何在角质形成细胞内加工,还有很多有待发现。在这里,本文讨论了黑色素转移和加工机制的现有知识和研究。这些知识对于理解皮肤着色的维持机制并为色素性疾病和化妆品应用提供治疗策略至关重要。
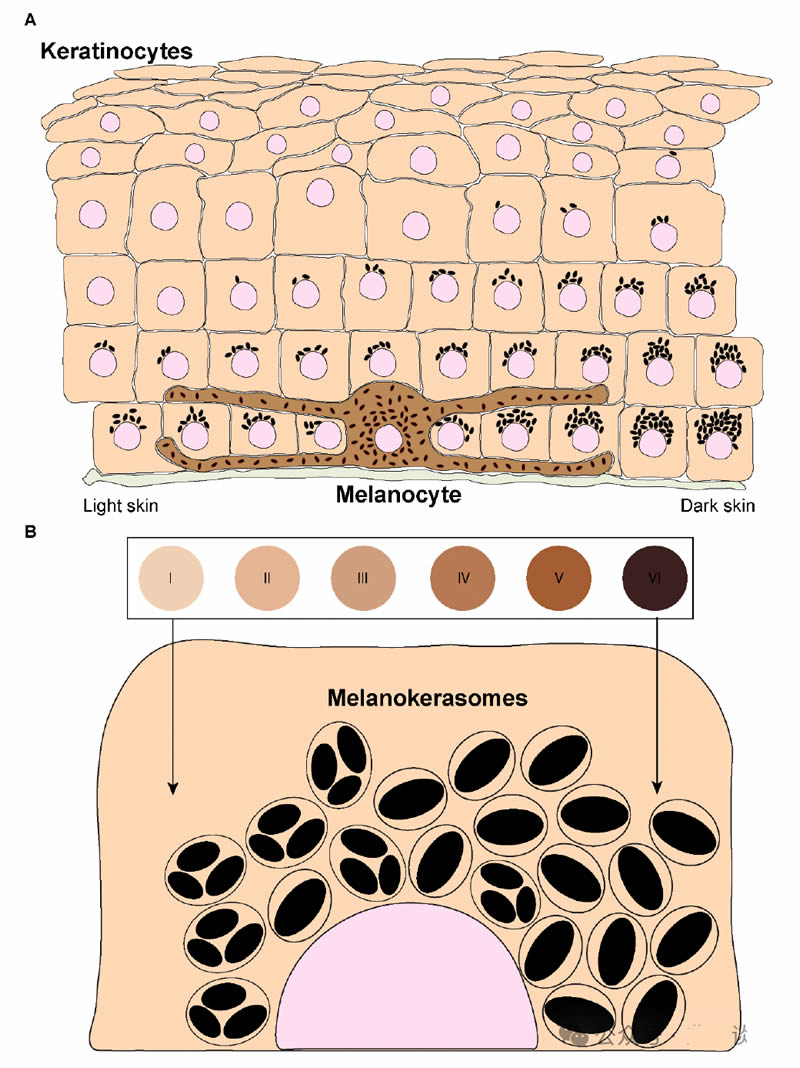
图1. 黑色素在表皮和角质形成细胞中的分布。(a)黑色素在表皮中的分散是通过表皮-黑色素单位的形成来实现的。无论皮肤光型如何(由编号的圆圈表示,从I型(较浅/较轻的皮肤光型)到VI型(较深/较暗的皮肤光型)),基底层的黑色素积累较高。在较浅的皮肤光型(低光型)中,基底层中黑色素的浓度较低,而在较深的皮肤光型(高光型)中,可以在基底层发现更高水平的黑色素,并且黑色素也存在于紧邻基底层的上层。(B)黑色素在来自不同光型的角质形成细胞内的组织不同。在较低的光型中,黑色素主要储存在单个膜细胞器内的几个黑色素颗粒簇中,而高光型在单个膜细胞器中显著积累单个颗粒。
02 黑色素转移模型
黑色素必须转移到角质形成细胞,才能发挥其光保护功能。早在 20 世纪 60 年代,当首次观察到黑色素从黑色素细胞转移到上皮细胞(角质细胞)时,黑色素转移的过程就一直是一个有争议的话题。为了解释黑色素是如何从黑色素细胞转移到角质形成细胞的,已经提出了多达四种模型,即使一些模型可能是相同模型的变体:(I)角质形成细胞吞噬含有黑色素体的黑色素细胞树突尖端;(II)角质形成细胞与黑色素细胞之间的膜融合以及黑色素体的直接转移;(III)黑素细胞脱落含有黑素体的小球,随后被角质形成细胞吞噬;(IV)黑色素细胞分泌黑色素核,随后被角质形成细胞吞噬(图2)。下文概述如下:
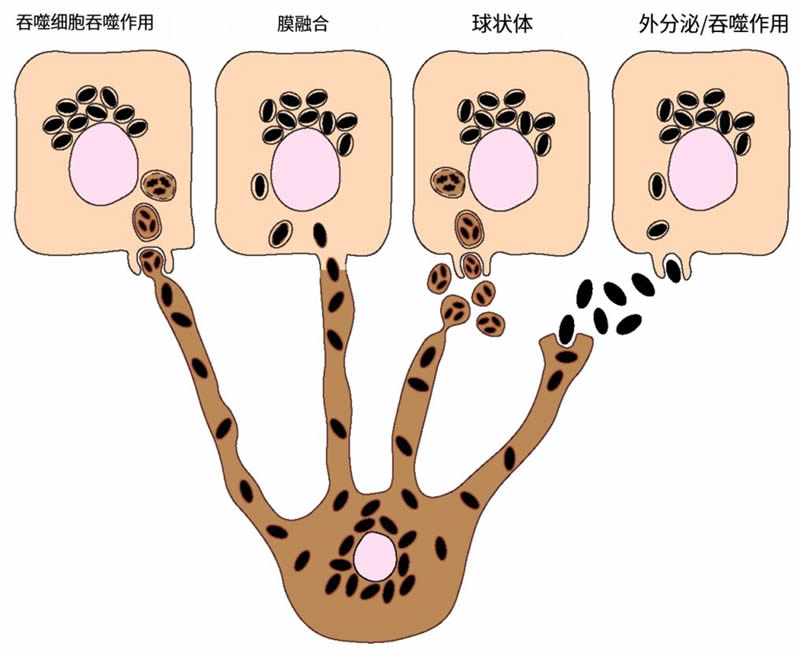
图2. 黑色素细胞向角质形成细胞转移黑色素。目前提出了四种不同的模型来解释黑色素从黑色素细胞(深色)转移到角质形成细胞(浅色)的机制,包括角质形成细胞吞噬黑色素细胞树突;黑色素细胞和角质形成细胞膜的直接融合;黑色素细胞脱落充满黑色素体的球状物;以及黑色素细胞的黑色素核心的联合外泌/吞噬作用。尽管使用不同模型发表了证据,但最近使用人类和小鼠细胞系的研究,以及更复杂的模型,如重建的人类皮肤/表皮和皮肤活检,支持黑色素以球状物或黑色素核心的形式转移。
1. 角质形成细胞对黑素细胞树突的细胞吞噬作用。
这种转移模式是在通过电子显微镜(EM)观察到体外培养的角质形成细胞内的黑色素细胞树突尖端后首次提出的。该过程可分为四个步骤:首先,黑色素细胞的树突尖端与角质形成细胞的质膜接触,随后被其吞噬;其次,黑色素细胞的树突尖端被切断,形成一个充满黑色素体的细胞质囊泡;第三步,黑色素所在的区域(理论上由三个不同来源的膜所包围——最内层是黑色素体的膜,以及黑色素细胞和角质形成细胞的质膜)与溶酶体融合,形成吞噬溶酶体。这导致管腔膜的降解。最后,吞噬溶酶体分裂成更小的囊泡,其中包含分散在细胞质中的黑色素颗粒聚集体或单个黑色素颗粒。
2. 黑色素细胞和角质形成细胞膜的融合。
该模型假设黑色素细胞和角质形成细胞的质膜融合,允许在相邻细胞的细胞质之间形成导管(例如丝状体或纳米管),黑素体通过该导管运输。如在细胞吞噬模型中,角质形成细胞接受膜结合的黑素体。然而,本文研究人员和Graça Raposo的研究小组发现角质形成细胞内的黑色素缺乏黑色素体标记。这种差异的一个可能解释是黑色素体膜在角质形成细胞内被内溶酶体系统降解。需要注意的是,这个模型和细胞吞噬模型可能代表了同一机制的不同变体。实际上,Desmond Tobin的研究小组提出了一个伪足-细胞吞噬模型,在这个模型中,黑色素细胞延伸出伪足,这些伪足与角质形成细胞的质膜结合,然后被角质形成细胞拉动并随后被吞噬。
3. 富含黑素体的球状物脱落。
该模型提出,黑色素细胞膜的出芽导致形成并释放出充满黑色素体的球状物(1-3微米大小),随后这些球状物被角质形成细胞吞噬。最近,其他研究表明,从人原代黑色素细胞的树突中分泌出充满黑色素体的球状物到细胞培养基中。当这些充满黑色素体的球状物从培养基中分离出来并与人原代角质形成细胞一起孵育时,它们以与细胞吞噬模型所假设的类似方式被内化并加工。事实上,根据这个模型,在内化时,黑色素被三层膜包围。加工后,含有黑色素的单层膜囊泡分散在角质形成细胞内部。
4. 黑色素核心的耦合胞吐/吞噬作用。
该转移模型预测黑素小体与黑素细胞质膜融合,导致裸露的黑色素核心,称为黑色素核心(melanocore),被外排到细胞外空间,并随后被角质形成细胞内化。因此,在内化过程中,黑色素核心周围会形成一层来自角质形成细胞质膜的单层膜。支持这一模型的首个证据来自对人类头发和皮肤中细胞外黑色素的观察,据推测这些黑色素以聚集体或单个颗粒的形式被角质形成细胞内化。最近,本文研究人员和其他研究人员提供了进一步支持该模型的证据,观察到黑色素核心位于黑色素细胞和角质形成细胞之间的间质空间内。他们还表明,角质形成细胞内的黑素核被缺乏黑素体标记物 TYRP1 的单层膜包围,这意味着在转移过程中原始的黑色素体膜已丢失。
不同的模型得到了多种实验体系的证据支持,包括原代细胞、细胞系和来自不同物种的组织外植体,如小鼠、豚鼠、鸡、青蛙和人类。在从黑色豚鼠耳朵分离的黑色素细胞和角质形成细胞的共培养中,有证据支持细胞吞噬转移模型。在青蛙皮肤细胞和组织中,黑色素转移被描述为通过脱落的充满黑色素体的球状物或黑色素体的外泌/吞噬作用发生,因为发现细胞外黑色素是膜结合的。在鸡胚皮肤中,黑色素被提议通过脱落的球状物转移。在小鼠中,黑色素转移发生在毛囊中,已经有证据描述了外泌/吞噬和脱落球状物模型。关于使用的不同系统,大多数研究是使用培养的黑色素细胞进行的,无论是单独培养还是与角质形成细胞共培养。然而,在皮肤表皮中,黑色素转移发生在排列在表皮黑色素单位中的黑色素细胞和角质形成细胞之间。因此,应该优先考虑能够再现这种排列的模型。此外,使用黑色素瘤细胞系研究色素转移的分子机制时应该谨慎,因为它们可能在黑色素的生产、处理和分泌方面表现出变化。重要的是,外泌/吞噬模型是收集了更多来自人体皮肤切片分析和体外重建的人类皮肤/表皮模型的支持证据的模型。脱落球状物是另一个被更多探索的模型。此外,这四个模型可以本质上分为预测裸黑色素(melanocore)转移的模型和预测膜结合黑色素体转移的模型。应该指出,不能排除黑色素转移的几种机制共存,即使是在同一个生物体中,作为对不同生理或病理条件的适应。为了解决这些长期存在的问题,对黑色素细胞外泌黑色素的途径和调节因子以及角质形成细胞内化的细胞和分子水平的更好理解是必要的。
03 黑素体转运和胞吐作用
黑素体先转运到黑素细胞的外周,再转移到邻近的角质形成细胞。已经鉴定出多个调节黑色素细胞细胞骨架上黑色素体运输的因子。脑中与Ras相关的蛋白(Rab)1,介导内质网(ER)-高尔基体运输,与SifA和驱动蛋白相互作用蛋白(SKIP)以及顺行微管依赖性驱动蛋白1相互作用,以调节黑色素体顺行运输(图3A)。微管上的逆行转运由高尔基体内和内体运输调节因子 Rab 36 和dilute抑制基因的产物,黑素调节蛋白介导,它们与 Rab 相互作用的溶酶体蛋白(RILP)和动力蛋白相互作用因子 dynactin亚基1(DCTN1)形成复合物(图 3A)。同样,分泌蛋白Rab44被报道与dynactin和微管依赖性动力蛋白形成三聚体复合物,以调节黑色素体逆行运输(图 3A)。在细胞外周,黑素小体锚定在皮质肌动蛋白网络上,并通过由分泌蛋白 Rab27a、衔接蛋白嗜黑素和肌动蛋白依赖性运动蛋白肌球蛋白 Va 组成的三方复合物单向转运至质膜(图 3A)。尽管对调节黑色素体内黑色素体定位的分子机制的了解日益增加,但尚未完全了解这些机制的相对重要性以及位置本身对黑色素转移效率的意义。
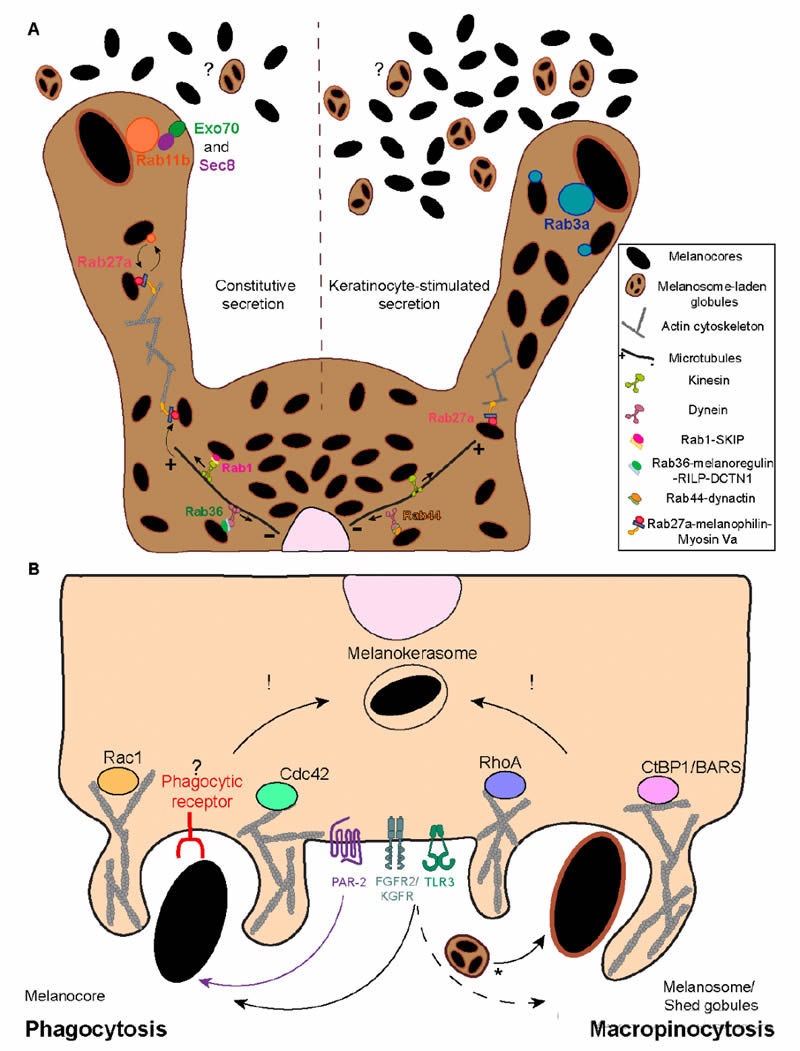
图3. 黑色素细胞的黑色素外泌作用和角质形成细胞的内化作用。(a)在生理条件下,黑色素外泌被认为发生在黑色素细胞树突的尖端,需要将黑色素体运输到细胞周边。顺行长程转运通过微管发生,并由复合物 Rab1-SKIP-驱动蛋白 1 介导。另一方面,逆行转运受 Rab36-黑素调节蛋白-RILP-DCTN1和/或 Rab44-动态肌动蛋白-动态蛋白调节。黑色素体定位是顺行和逆行运输平衡的结果。由于逆行运输优先于顺行运输,黑色素体倾向于在核周区域积累。黑素体的外周定位依赖于由 Rab27a-嗜黑素-肌球蛋白 Va 组成的三方复合物。小GTPase Rab11b和外泌体复合物亚基Exo70和Sec8被发现可以调节基础黑色素胞吐和转移。此外,Rab3a在分化角质形成细胞衍生的可溶性因子刺激下,增强了向角质形成细胞的黑色素外泌和转移。目前尚不清楚黑色素体负载的球状物是否也使用相同的分子调节器从黑色素细胞中分泌出来(标记为“?”)。(B)近期研究发现,根据黑色素呈现给角质形成细胞的方式,即“裸”黑色素核心(melanocores)或膜结合的黑色素体,参与黑色素识别和内化的分子角色存在关键差异。黑色素核心被证明以PAR-2依赖的方式被角质形成细胞吞噬,需要Rac1和Cdc42以实现有效的内化。识别黑色素核心的吞噬受体的存在和身份仍然不明(标记为“?”)。相比之下,纯化的膜结合黑色素体通过巨胞饮作用以PAR-2独立的方式内化,需要RhoA和CtBP1/BARS。黑色素体负载的球状物的内化是否需要与黑色素体相同的调节器仍有待确定(标记为“*”)。此外,FGFR2b/KGFR和TLR3的刺激被证明可以增强黑色素体和黑色素核心的内化,尽管其机制尚未表征。不同内化途径的存在是否影响黑素小体的加工尚不清楚(用“!” )。
有趣的是,另一种肌动蛋白依赖性运动——肌球蛋白 X——被证明通过丝状体/纳米管组装调节黑色素向角质形成细胞的转移。此外,N-甲基-D-天冬氨酸受体、细胞间粘附分子 E-钙粘蛋白和粘附内体蛋白 Rab17 也与黑色素通过丝状体形成的转移有关。进一步地,需要形成称为囊泡的质膜内陷的质膜蛋白caveolin-1和cavin-1,已被证明对黑色素细胞-角质形成细胞接触、黑色素细胞树突状结构和黑色素转移是必需的。然而,尚不清楚这一过程可能涉及哪些转移模型。
本文研究小组发现,蛋白Rab11b以及外泌体锚定复合物的两个亚基(Exo70和Sec8)在黑色素外泌和转移中扮演了关键角色,支持了外泌/吞噬模型(图3A)。最近,研究人员发现与未分化角质细胞衍生的可溶性因子相比,分化的棘层/颗粒层角质细胞衍生的可溶性因子能够增加黑色素细胞的黑色素外泌。他们还发现,在分化的棘层/颗粒层角质细胞的刺激下,分泌型Rab蛋白Rab3a能够增强黑色素外泌和向角质细胞的转移(图3A)。因此,这些研究支持了存在一种依赖于Rab11b的基础黑色素转移途径,以及一种由角质细胞刺激的依赖于Rab3a的黑色素转移途径。重要的是,他们观察到Rab3a刺激的黑色素外泌是由角质细胞衍生的可溶性因子触发的,而不是由细胞外囊泡触发的。尽管如此,先前的研究报告称角质细胞衍生的细胞外囊泡能够刺激黑色素细胞合成黑色素。因此,研究人员假设当黑色素转移需要上调时,例如在紫外线照射后,也称为兼性色素沉着时,需要Rab3a刺激的黑色素外泌途径。此外,Rab11a被发现在Toll样受体-2(TLR-2)激活时调节黑色素外泌。最后,肌动蛋白重塑小GTPase Ras同源基因家族A(RhoA)被证明是鸡胚皮肤中膜起泡和释放黑色素体小球所必需的。
更好地理解可能存在的反馈循环,即将黑色素合成、黑色素体运输和外泌联系起来,将有助于阐明为什么不同的途径可以在不同的环境中实现黑色素的转移。此外,了解黑色素外泌的分子调节器是否能够共同作用或在不同的途径中起作用将是至关重要的。最后,未来的研究应该探索不同的刺激是否需要不同的蛋白来调节黑色素外泌,以及不同的分子调节器是否与人类皮肤中不同的黑色素转移模式和色素沉着水平有关。
04 黑色素内化
有效的皮肤色素沉着和光保护取决于角质细胞内化黑色素的能力。然而,通过角质形成细胞调节黑色素内化的机制仍然知之甚少。最近对小鼠和人类细胞的研究报道,角质形成细胞内化分泌的黑色素(黑色素核或黑色素小体小球)可能是皮肤中黑色素转移的主要模式。考虑到黑素小体的生理大小(直径0.3-0.5µm),预计只有巨噬和吞噬作用才能使如此大的货物内化。虽然角质形成细胞不是专业的吞噬细胞,但它们已被证明可以有效地吞噬乳胶珠和细菌。此外,角质形成细胞吞噬能力的刺激导致黑色素转移的增加,强烈提示吞噬作用参与角质形成细胞的黑色素内化。
巨噬作用和吞噬作用都高度依赖于肌动蛋白细胞骨架重塑,而肌动蛋白骨架重塑是由Rho小GTPase调节的。因此,研究表明,黑色素内化需要动态肌动蛋白重塑,并且依赖于Rho GTPases。有趣的是,黑素核和黑素小体需要不同Rho gtpase来内化:黑素核以Rac1-和Cdc42依赖的方式内化,而黑素小体的内化遵循RhoA依赖的途径(图3 b)。这些观察结果与先前的一项研究一致,该研究表明 在TLR3刺激下富含黑素小体的小球的内化依赖于 RhoA的活性,并且需要Cdc42。此外,研究人员观察到黑素小体而非黑素核内化受到微红细胞增多症抑制的损害。总之,这些观察结果表明,角质形成细胞对黑色素的识别和内化涉及不同的机制,黑色素核通过吞噬作用内化,黑色素小体通过巨噬作用内化。重要的是,目前没有证据表明单个黑色素体发生了转移,尽管这代表了一个很好的对照,因为黑色素核心与黑色素体之间唯一的区别在于黑色素体周围存在膜结构。
角质形成细胞对黑色素核心的特异性识别可能需要膜受体的参与,以实现它们的吞噬作用。在角质形成细胞摄取黑色素的过程中,最著名的受体是蛋白酶激活受体-2(PAR-2)。在表皮中,PAR-2在颗粒层(颗粒层)中高度表达,参与表皮屏障维持、角化细胞分化和色素沉着。这种七跨膜G蛋白偶联受体(GPCR)被丝氨酸蛋白酶 (例如胰蛋白酶)切割PAR-2细胞外N端区域的特定区域。因此,暴露了一个新的N端序列(SLIGKV [Ser-Leu-Ile-Gly-Lys-Val-NH2] 在人类中),它通过结合一个保守区域自动激活受体,导致受体构象和细胞内信号传导的变化。使用胰蛋白酶或合成SLIGKV激活PAR-2可增强角质细胞的体外吞噬,而大豆胰蛋白酶抑制剂抑制PAR-2,可降低其吞噬能力。在体内,合成丝氨酸蛋白酶抑制剂RWJ-50353抑制PAR-2激活,防止紫外线诱导的色素沉着,并以浓度依赖的方式增强色素沉着。有趣的是,PAR-2的表达水平与皮肤的光型相关,即,与浅色皮肤相比,深色皮肤在整个表皮中表现出更高的表达水平和活性,浅色皮肤的PAR-2表达和活性集中在下层。重要的是,体外和体内PAR-2刺激可增加角质形成细胞黑色素含量,其激活可增强角质形成细胞对黑色素、珠状细胞、 和大肠杆菌K-12的吞噬能力。此外,PAR-2在角质形成细胞中的激活通过Rho GTPases发出信号。此外,研究小组发现黑素核(而非黑素小体)依赖PAR-2被角质形成细胞摄取,这支持了黑素核是黑色素转移到角质形成细胞的形式和外吞噬模型的观点(图3B)。最近,也有研究表明,阳离子通道瞬时受体电位锚蛋白1(TRPA1)是调节角化细胞吞噬黑素核的PAR-2活性所必需的。除PAR-2外,其他受体的刺激,包括TLR-3和成纤维细胞生长因子受体2/角化细胞生长因子受体(FGFR-2/KGFR),被描述为参与角化细胞的黑色素吞噬(图3B)。有趣的是,虽然本文的研究小组发现了黑色素核特异性激活PAR-2的证据,但其他人发现TLR-3可以调节角质形成细胞的黑色素核和黑色素小体内化。因此,这些报告强化了黑色素呈现给角质形成细胞的方式,即黑色素核或膜结合黑色素小体中的裸黑色素,导致不同受体的激活,并可能不同的下游信号通路。值得注意的是,FGFR-2/KGFR表达与肤色呈负相关,即在浅色皮肤角质形成细胞中表达更多。这与PAR-2表达模式相反,后者在深色皮肤中表达更高。未来研究中,如何将这一点与PAR-2的表达模式协调起来,将有助于更好地理解不同形式内化的黑色素(膜结合的载有黑色素体的球状物或黑色素核心)对肤色类型的贡献,这是一个值得探索的有趣问题。最后,UVr对黑色素内化的刺激作用也值得一提。PAR-2的表达和活性,以及FGFR- 2/KGFR活性,可以通过暴露于UVr增强,增加黑色素转移。此外,最近的一项研究表明α7烟碱乙酰胆碱受体(nAChR) 通过增加角化细胞对黑色素小体的吞噬来响应UVr暴露。
尽管人们普遍认为吞噬作用是黑色素的内化途径,但直到最近才有明确的证据证明这一点。由于吞噬作用是一个受体介导的过程,它需要对货物的特定识别才能内化。有证据表明黑色素核和黑色素小体需要不同的调节因子来内化,这进一步支持了黑色素被角质形成细胞识别的不同观点,这取决于周围膜的存在与否。未来研究中需要探讨载有黑色素体的球状物是否表现为黑色素体。此外,目前尚不清楚黑色素核心上存在的分子决定因素,这些因素对于它们的特异性识别是必需的,应该进行调查以确定涉及的吞噬受体。重要的是,广泛用作黑色素内化对照的珠子,很可能缺乏对黑色素特异性识别所需的分子决定因素。因此,尽管努力使用与黑色素体大小相似的珠子,但它们很可能不是研究角质形成细胞内化黑色素的合适模型。
尽管有大量证据表明PAR-2以及其他受体(例如FGFR2/KGFR、TLR-3)在黑色素内化中扮演着重要角色,但它们在这一过程中的功能可能是间接的,即提高角质形成细胞的整体吞噬效率,而不是直接参与黑色素的识别。实际上,像PAR-2这样的G蛋白偶联受体(GPCRs)被证明能够识别微生物分泌的趋化因子,通过肌动蛋白细胞骨架的重塑增强吞噬能力。因此,PAR-2可能需要用于趋化作用,即引导角质形成细胞朝向黑色素并促进其吞噬。同样,尽管TLRs能够识别不同货物上的分子模式,但它们并不是吞噬受体,而是合作促进吞噬作用的启动。此外,PAR-2在颗粒层中高度表达,而黑色素转移主要发生在基底层,这表明黑色素内化可能受到上皮基底层角质形成细胞的旁分泌调节。这进一步意味着PAR-2可能并不直接参与黑色素的识别,而是在调节角质形成细胞的吞噬活动中发挥作用。因此,角质形成细胞如何识别黑色素核心以触发它们通过吞噬作用的内化仍有待解决。可能的候选者包括C型凝集素受体,特别是考虑到最近的研究显示,表达在内皮细胞和髓样细胞中的MelLec受体能够特异性识别真菌黑色素。有趣的是,角质形成细胞表达C型凝集素受体Dectin-1,已知其参与创伤再上皮化和角质形成细胞介导的先天免疫反应。尽管真菌黑色素与哺乳动物黑色素之间存在差异,但测试C型凝集素受体如Dectin-1在人类黑色素识别中的参与是值得的。值得注意的是,角质形成细胞表达Fc-γ受体,如在银屑病等炎症性皮肤疾病的背景下所描述的。据本文研究人员所知,Fc-γ受体在角质形成细胞内化黑色素中的作用尚未被研究,但在未来的研究中探索这一点可能是有趣的。Fc-γ受体需要被吞噬的颗粒上结合一个调节剂(例如,一个抗体)。这引发了一个问题,即黑色素是否也需要一个调节剂才能被角质形成细胞识别和内化。
确定参与黑色素内化的吞噬受体可以为调节这一过程提供吸引人的靶点,进而影响皮肤颜色。此外,对受体和黑色素内化所涉及的下游信号通路的表征也可以阐明调节黑色素在角质形成细胞内处理和定位的机制,如下文所讨论的。
05 黑色素处理
黑色素处理指的是黑色素在被角质形成细胞内化后在细胞内发生的步骤。值得注意的是,尽管角质形成细胞是黑色素的受体细胞,黑色素发挥光保护作用,并且黑色素处理的差异与皮肤光型相关,但涉及的机制仍然不清楚。实际上,在浅色皮肤中,黑色素主要积累在表皮的基底层角质形成细胞内,而在深色皮肤中,黑色素也存在于上层细胞的角质形成细胞中(图1A)。重要的是,已经确定黑色素在角质形成细胞内的组织方式在不同光型之间有所不同。在浅色皮肤中,黑色素以簇的形式存在,而深色皮肤主要包含单个黑色素颗粒,这些颗粒通常较大,尽管含有黑色素的细胞器在浅色和深色皮肤中显示出相似的大小(图1B)。建立簇或单个颗粒涉及的机制基本上未知,除了它们依赖于角质形成细胞的皮肤光型,并且与转移的黑色素类型(真黑色素与褐黑色素)无关。
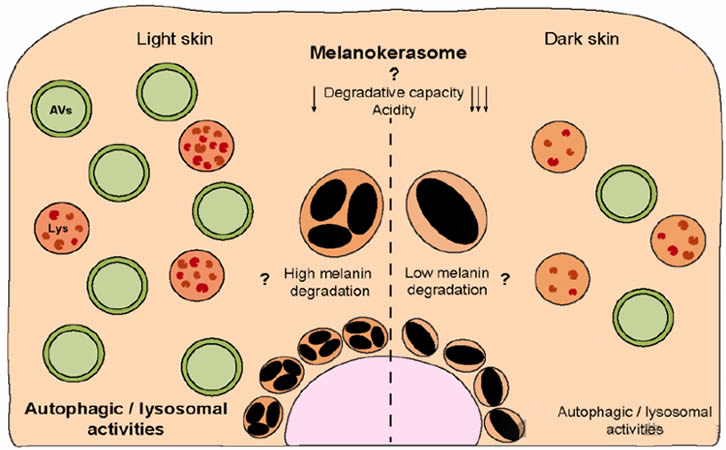
黑色素在黑色素细胞和角质形成细胞中的代谢被认为受到自噬作用的调控。在角质形成细胞中,自噬/溶酶体活性与皮肤颜色呈负相关,即在浅色皮肤来源的角质形成细胞中活性更高,而在深色皮肤来源的角质形成细胞中活性较低,这一点与角质形成细胞的分化状态无关(图4B)。此外,在不同的实验条件下(2D或3D培养和皮肤外植体)对自噬进行药理学或遗传学调节,已被证明可以改变角质形成细胞中的黑色素含量(见表1)。实际上,自噬的诱导被发现可以导致角质形成细胞内黑色素水平的降低,而自噬抑制剂则导致这些水平的增加。这分别归因于黑色素的降解与持续存在。值得注意的是,随着年龄的增长,表皮中自噬活性的下降导致黑色素的积累,特别是在角质形成细胞内,形成如老年性色素痣所见的色素沉着病变。有趣的是,自噬在老化皮肤中的诱导可以恢复色素沉着,这加强了自噬在黑色素代谢中的重要性。
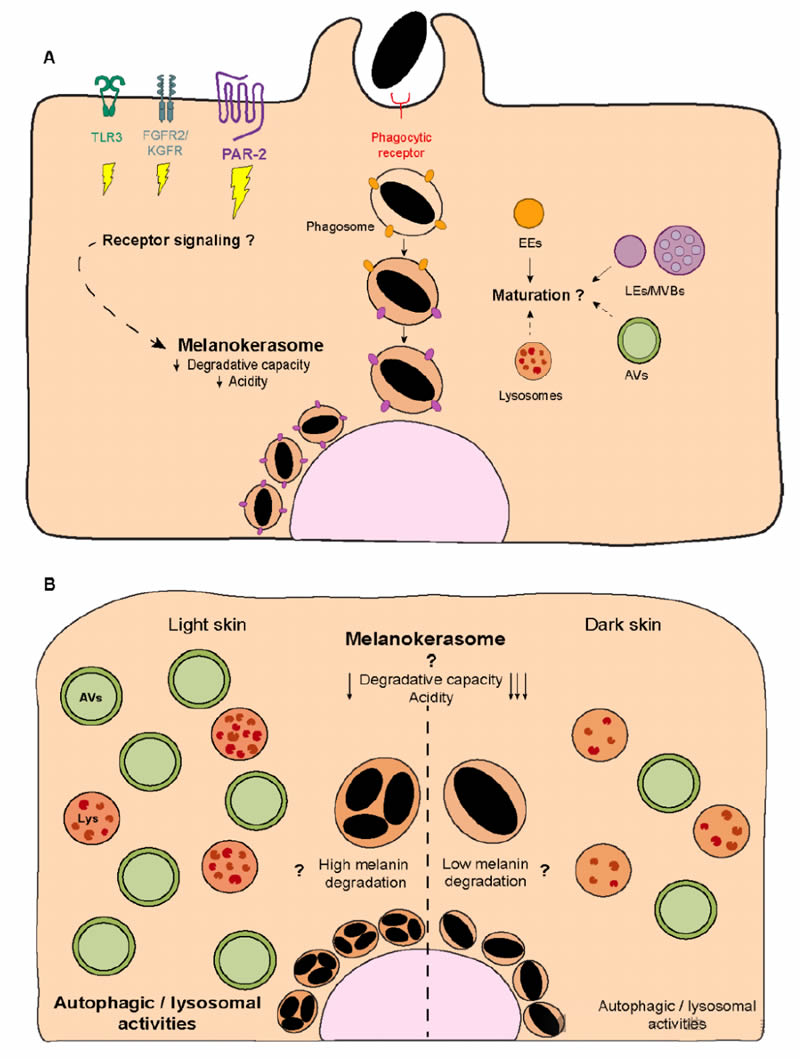
图4. 角质形成细胞内黑色素的处理。(A) 最近的研究表明,转移到角质形成细胞内的黑色素被早期和晚期内吞标记物所包围。这种细胞器是否经历了进一步的成熟尚不清楚,但最近的观察表明黑色素被储存在一个称之为黑色素角化体(MKS)的特化细胞器中,它具有酸性较弱的腔室和非降解性质。尽管早期内吞、晚期内吞和自噬囊泡可能参与了MKSs的形成,但其他细胞器对MKSs生物合成的贡献尚不完全清楚。此外,受体信号(例如,PAR-2、KGFR/FGFR2和TLR3或吞噬受体)对MKSs的运输和生物合成的相关性也不清楚。(B) 自噬被报道可以调节角质形成细胞内黑色素的降解,尽管具体的机制尚不清楚。此外,与深色皮肤相比,浅色皮肤的自噬和溶酶体活性更高。然而,尚不完全清楚不同光型来源的MKSs在允许黑色素持续存在或降解的能力方面是否表现出不同的特性(箭头表示——箭头越多表示降解能力和酸性越低),以及自噬/溶酶体活性(用“?”标记)对此的贡献。EEs——早期内体;LEs——晚期内体;MVBs——多泡体;AVs——自噬囊泡;Lys——溶酶体。
尽管观察到黑色素在角质形成细胞中不存在于双层膜的细胞器,即自噬体中,并且含有黑色素的细胞器缺乏经典的自噬体蛋白LC3。实际上,黑色素被发现存在于角质形成细胞内的单膜细胞器中,这支持了外泌/吞噬作用或黑色素细胞和角质形成细胞膜融合转移模型(图4A)。尽管缺乏明确的证据,已有提议在细胞吞噬和脱落球状物模型中,包围黑色素的膜结构在角质形成细胞内处理过程中被降解。例如,有人提出在黑色素体内化过程中,黑色素体膜蛋白TYRP1可能被迅速移除,可能是通过降解,但涉及的机制尚未被研究。这导致在角质形成细胞内形成单膜黑色素含物细胞器。表征这些细胞器形成过程中涉及的分子机制对于更好地理解色素在角质形成细胞中的命运至关重要,而这个问题直到最近才开始得到解决。Graça Raposo的研究小组显示,无论皮肤光型如何,溶酶体相关膜蛋白1(LAMP1)和四跨膜蛋白细胞表面抗原63(CD63)——晚期内体(LEs)/溶酶体的标志物——存在于单发和聚集的黑色素核心的膜上(图4A)。此外,研究发现在小鼠角质形成细胞中,含有黑色素的细胞器对早期内吞标记物早期内体抗原1(EEA1)和Rab5,以及LAMP2和CD63呈阳性(图4A)。值得注意的是,这些实验在固定的时间点进行,因此,没有评估细胞器的成熟和动态变化。相应地,包括LE/溶酶体Rab7b在内的几种Rab小GTP酶被发现定位于小鼠角质形成细胞内含有黑色素的细胞器中。
此外,本文研究人员和Graça Raposo的研究小组表明,黑色素在角质形成细胞内积累于适度酸性的细胞器中(这些细胞器表现出低水平的Lysotracker和DAMP[3-(2,4-二硝基苯胺基)-3'-氨基-N-甲基二丙胺]积累),并且降解能力较低,这一点通过低水平的染料猝灭牛血清白蛋白(DQ-BSA)荧光显示出来,尽管这类细胞器在角质形成细胞内非常丰富(图4A)。实际上,报告称在培养的小鼠角质形成细胞中,黑色素具有较长的寿命并且能够长时间持续存在,这表明含有黑色素的细胞器专门用于角质形成细胞内长期储存黑色素。我们将这些角质形成细胞内的黑色素含物细胞器称为黑色素角化体(MKSs),以区别于黑色素细胞中的黑色素体。MKSs很可能是独特的黑色素储存细胞器,表现出低酸度和降解能力,但保持了晚期内体(LEs)/溶酶体的特征,包括膜标志物LAMP1/2和CD63(图4A)。鉴于CD63经常与特定细胞类型中的LROs(溶酶体相关器官)相关联,并且LROs与溶酶体相比也表现出适度的腔室酸度和降解能力,已有提议MKSs可能是LROs的一种新类型。尽管这是一个有趣的假设,赋予了MKSs作为功能性细胞器的额外重要性,但MKSs起初是作为吞噬体开始的,因此它们不是内体衍生的,也已知不会从高尔基体接收货物。此外,没有证据表明MKSs能够进行调节性外泌作用,这是LROs最显著的区别特征。另一种可能是MKSs是溶酶体衍生的细胞器,或者代表一个已经失去降解能力的功能障碍溶酶体。的确,这可以解释黑色素在角质形成细胞内的持续存在。然而,不能排除黑色素对降解有抵抗力的可能性(见下文)。因此,未来的研究应该以动态的方式表征MKSs的形成,即考虑其时空成熟度和与其他细胞器的相互作用,以及它们如何使黑色素持续存在。这将有助于理解这些专门用于黑色素储存的细胞器的生物合成和生命周期。
另一个相关的问题是黑色素内化是否与其在角质形成细胞内的命运相关。这不仅适用于转移方式对黑色素处理方式的影响(黑色素体、载有黑色素体的球状物或黑色素核心的转移),还涉及到膜受体(如PAR-2、FGFR-2/KGFR和TLR-3)下游激活的信号通路的贡献(图4A)。例如,PAR-2已被证明通过磷脂酰肌醇3激酶(PI3K)/蛋白激酶B(Akt)/哺乳动物雷帕霉素靶蛋白(mTOR)途径在肾脏细胞中减少自噬。此外,当这条途径被饮食黄酮类化合物异甘草素抑制时,发现黑色素降解被促进,因此自噬被激活(表1)。的确,不同黑色素内化途径对处理的贡献尚不清楚。有趣的是,本实验室之前的工作表明,黑色素簇可以被皮肤中的角质形成细胞内化。这引发了一系列问题,包括在浅色皮肤中发现的簇是在内化过程中形成的还是在角质形成细胞内处理后形成的。目前也不清楚黑色素处理在不同光型中是否不同,以及这如何促成在浅色和深色皮肤中观察到的不同组织模式。特别是,与深色皮肤相比,浅色皮肤的自噬/溶酶体活性增加,这表明不同光型来源的角质形成细胞存在不同的黑色素降解能力(图4B)。这也可能解释了在深色皮肤中检测到的上皮基底层黑色素,可能由于黑色素降解减少或延迟所致(图4B)。因此,澄清黑色素内化和自噬对角质形成细胞内黑色素组织的贡献至关重要。MKS的形成和处理,从黑色素内化开始,最终建立一个独特的储存隔室,即MKS,可能由多个因素决定。
引人注目的是,关于角质形成细胞内黑色素降解的证据相互矛盾,而且尚不清楚黑色素是否可以降解。鉴于它的保护特性,黑色素应该被保存下来,而MKS的特性,即适度的酸度和降解能力,表明了这一点。事实上,黑色素的溶解度在碱性条件下增加,而在酸性环境中仍不溶并沉淀。黑色素的水解降解在体外的尝试结果表明,虽然蛋白质和脂质被降解,但黑色素部分得以保留。因此,MKSs的形成是否对黑色素在角质形成细胞内的保存和/或降解是必需的仍需进一步确定。有趣的是,真菌黑色素被证明能够抑制与LC3相关的吞噬作用(LAP),并促进烟曲霉的致病性。此外,研究人员提出黑色素与微生物共享了颠覆细胞内运输通路以抵抗降解的能力。因此,LAP在黑色素处理中的潜在作用应进行测试。尽管黑色素在角质形成细胞内的寿命较长,但它主要定位于基底层,而在较深的光型中,其在整个表皮中的积累才变得明显,此时上层角质形成细胞保留了被称为“黑色素尘埃”的降解黑色素碎片。值得注意的是,在使用Fontana Masson染色时观察到的角膜层中的黑色素(“黑色素尘埃”)在电子显微镜下几乎无法找到,因此被归因于该染色的伪影。这再次引发了一个问题,即黑色素在角质形成细胞分化过程中是否可以被降解,以及是否有合适的工具来准确进行这一分析。最近,黑色素在基底层的积累被归因于角质形成细胞的不对称分裂,基底角质形成细胞保留了色素。重要的是,同一研究表明,在压力条件下(例如再生皮肤),对称分裂被优先考虑,导致色素在子代和祖代角质形成细胞之间的更广泛分布。因此,应该评估基底层中黑色素浓度是否源于降解缺失、不对称细胞分裂,或两者兼而有之。此外,黑色素处理是通过不同模型进行研究的,包括人类皮肤外植体、原代人类角质形成细胞以及小鼠/人类角质形成细胞系。因此,尽管已有相关观察,但迫切需要开发新的策略,以在更具生理相关性的模型中研究黑色素处理的动态。此外,只有结合不同的方法,才能对黑色素在角质形成细胞内的命运进行可靠的分析。
06 黑色素极化
黑色素的加工过程最终以极化形成帽状结构,或称为“遮阳伞”,保护角质形成细胞核中的遗传物质免受紫外线辐射(UVR)引起的遗传毒性效应(图5)。实际上,先前的研究表明,与不含核上黑色素帽的细胞相比,具有核上黑色素帽的细胞中环丁烷嘧啶二聚体(CPDs)和(6-4)光产物(6-4PP)的形成显著减少。尽管核上黑色素帽在抵御UVR方面的重要性已经得到明确证实,但皮肤中黑色素极化的机制仍有待揭示。有研究表明,核上黑色素帽的形成可能受到UVR的刺激。实际上,最近有报道称UVA辐射通过G蛋白偶联受体蛋白视紫红质3诱导黑色素极化。然而,结果表明,在没有UVR暴露的情况下,重建的人类表皮中也可以形成核上黑色素帽。因此,未来的研究应该确定是什么驱动了黑色素极化和核上帽的形成。有趣的是,有初步的未发表数据表明,涉及增殖、分化和迁移的角质形成细胞的层状结构,可以导致黑色素在核上帽中的组织,类似于细胞器向迁移细胞前缘的极化。
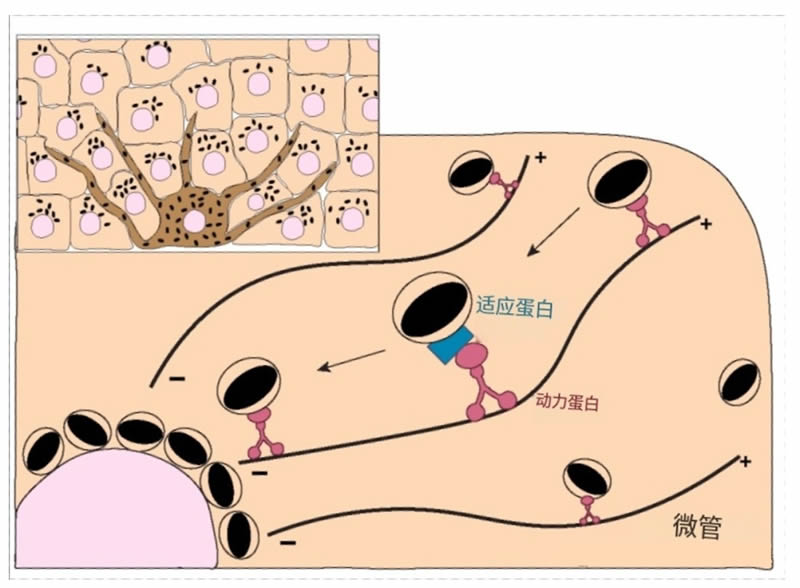
图5.黑色素在角质形成细胞内的运输和定位。黑色素在角质形成细胞的核上区域的积累对其在皮肤中的光保护特性至关重要。尽管这一过程很重要,但所涉及的分子机制仍然知之甚少。已知黑色素在动力蛋白-动力蛋白运动复合物介导的过程中沿微管逆行运输。目前尚不清楚接头蛋白(或以“?”标记的蛋白)是否参与这一过程,也不知道转运是如何被调节的。
关于黑色素极化的参与分子,先前的研究表明,细胞质动力蛋白的中间链在培养的人类角质形成细胞和人类皮肤外植体中与黑色素共定位。该研究还报告称,使用针对细胞质动力蛋白重链的反义DNA处理会导致人类角质形成细胞中核周黑色素的显著分散。后续研究表明,沉默dynactin p150Glued亚单位会损害人类角质形成细胞中微球的核周聚集,这表明黑色素极化依赖于细胞质动力蛋白-动力蛋白复合物。这些结果得到了最近研究的进一步证实,研究报告称在破坏肌动蛋白细胞骨架和微管网络后,黑色素极化显著受损。此外,研究还报告了黑色素、中心体和核卫星在角质形成细胞顶端区域的共定位,提示中心体相关蛋白在黑色素极化调节中的潜在作用。因此,目前对角质形成细胞内黑色素极化所涉及的分子机制知之甚少。特别是,逆行动力蛋白/动力蛋白依赖的运输是如何调节的,以及LEs/溶酶体使用的相同机制是否也被MKSs所采用,仍有待确定。鉴于Rab7b与MKSs的关联以及Rab7在LEs/溶酶体逆行运输中的作用,应该确认Rab7是否也参与黑色素极化。
07 结论与未来展望
与黑色素合成、黑色素体生物合成、成熟和运输的机制相比,黑色素外泌、转移和处理的机制知之甚少。事实上,该领域最具有争议的话题之一仍然是黑色素细胞与角质形成细胞之间的黑色素转移。迄今为止,这一问题主要在培养的原代细胞和细胞系中进行研究,包括来自黑色素瘤和不同动物模型的细胞。然而,这些模型在研究色素沉着方面有明显的局限性,因为它们不能完全再现人类皮肤结构的复杂性和体内发生的相互作用。此外,由于它们的转化,可能在涉及的机制上发生变化。组织外植体也被使用过,尽管它们再现了皮肤色素沉着的生理学,但在培养中会发生变化。重建色素皮肤/表皮和最近的皮肤芯片模型的出现,为调控黑色素细胞和/或角质形成细胞以及在非常接近生理环境的条件下理解皮肤色素沉着的机制带来了可能性。因此,应该进一步探索这些模型,以确定在构成性色素沉着和诱导性色素沉着,以及病理条件下是否可能发生不同的黑色素转移模式。
关于黑色素从黑色素细胞外排的过程,目前已有多项研究识别出调控该过程的多种分子。然而,人们对于基础和刺激途径中涉及的分子机制的了解才刚刚开始。因此,未来的研究应该探讨能够触发刺激黑色素释放的受体、信号和分子。此外,这些信号通路和分子调节器在生理条件(基础或兼性色素沉着)或病理条件(色素障碍)下是否相同,仍有待确定。毫无疑问,更好地理解由可溶性因子、细胞外囊泡和细胞间接触介导的黑色素细胞-角质细胞相互作用,将是解开这一谜团的关键。事实上,在人类皮肤外植体中,黑色素小体被发现非常接近黑色素细胞和角质细胞的膜,这表明这两种细胞类型之间存在紧密的联系,尽管没有膜融合。这种结构类似于众所周知的免疫突触和神经突触,表明存在一种色素突触,通过该突触,角质细胞和黑色素细胞可以相互通信,以控制表皮中黑色素的产生和转移。需要更多的研究来表征这种假定的色素突触。
现有证据表明,黑色素核心(melanocores)通过吞噬作用被角质细胞内化,但具体的吞噬受体尚不明确。因此,确定黑色素核心中存在的分子决定因素以及专门识别它们的受体对于在分子水平上阐明黑色素转移途径至关重要。另一个尚未解决的基本问题是,内化途径和下游信号通路是否会影响黑色素在角质细胞内处理的命运。关于不同光型角质细胞内黑色素组织差异的机制也是一个尚未解决的有趣问题。与此同时,了解作为独特黑色素储存细胞器的黑色素核心(MKSs)如何形成以及对其进行进一步表征,对于揭示角质细胞内精细调节黑色素持久性的机制至关重要。此外,这还可以为细胞内细胞器如何适应特定功能提供新的见解。尽管有几项研究表明调节这一途径会改变角质细胞中的黑色素含量,但尚未解决的问题还包括自噬如何调节角质细胞内黑色素转运的机制。重要的是,必须确定黑色素是否可以完全降解,以及转运是否涉及黑色素组织的改变,即深色光型中的单个黑色素颗粒或浅色光型中更典型的黑色素簇。这些研究将对不同光型中黑色素在表皮中的分散特性以及诸如炎症后色素沉着和老年性雀斑等条件下黑色素在角质细胞内的积聚产生重大影响。最后,应确定是什么信号使黑色素在核上帽中极化,以及这些信号如何在角质细胞的整个生命周期中得以维持。这些问题的答案将揭示对皮肤色素化至关重要但至今仍难以捉摸的基本机制,并为调节皮肤色素沉着提供新的靶点,以治疗色素障碍性疾病,以及应用于化妆品中。